C-糖苷分子骨架广泛存在于天然产物、药物以及生物体系中,以格列净类口服降糖药为例,这类药物通过抑制肾脏中的葡萄糖转运体,减少肾脏对葡萄糖的重吸收,在降血糖和增强心血管功能方面具有显著的治疗效果。然而,实现精准控制该类C-糖苷键的化学立体构型是一项高难度的合成挑战。在已有的前沿催化研究中,糖骨架的手性环境通常诱导了该化学键的异构立体选择性。如果能够摆脱糖分子骨架固有的手性,通过手性配体诱导实现高选择性获得两种异构C-糖苷,将大大加速推动其在生命健康等领域的应用。
上海科技大学物质科学与技术学院叶柏华课题组专注于研究新型过渡金属催化合成生物活性分子,其在Cell旗下期刊Chem上前后发表了两篇研究工作:(1)锆介导钯催化芳杂环穿梭交叉偶联催化 (Chem, 2021, 7, 1963-1974);(2)锆氢催化多肽分子还原交叉胺化反应 (Chem, 2023, 9, 869-880)。在此系列研究工作基础上,叶柏华课题组发展了新型锆氮杂环丙烷介导的开壳镍催化,首次实现了配体手性诱导合成系列手性C-糖苷化合物,近期以全文形式刊登在《美国化学会志》(Journal of American Chemical Society, JACS) (图一)。
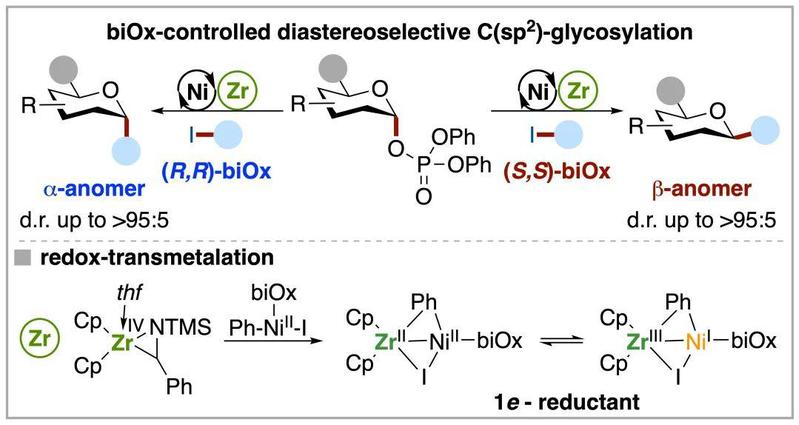
图一:锆介导手性镍催化C-糖基化反应
本研究实现了在常规温和条件下糖基磷酸酯与一系列(杂)芳基和糖烯碘化物作为偶联试剂的非对映选择性亲电偶联,展示了广泛的底物适用范围和对各种官能团的高耐受性。更重要的是,通过使用结构简单、易得的手性双恶唑啉(biOx)配体高选择性控制了两种异构体的形成。图二展示了卡格列净与其非对应异构体的合成,以及在糖磷酸酯与糖烯碘的偶联中,biOx配体主导支配了催化反应的空间选择性。因此,该方法学在合成C-糖苷化合物上具有很好的普适性,以便后期进一步探索该类分子在其他疾病治疗上的潜在应用。
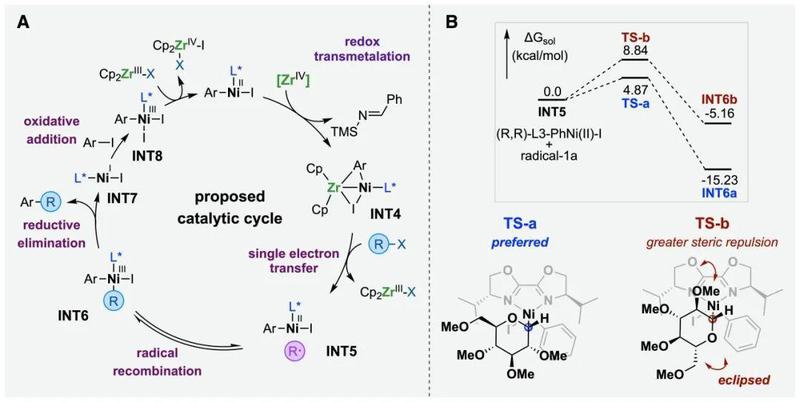
图二:锆介导手性镍催化C-糖基化底物探索示例
机理实验和理论计算的研究结果显示(见图三,A),锆氮杂环丙烷的作用并不仅仅是替代经典体系中的还原剂,而是在其独特的氧化还原转金属化机制中,形成了一种瞬态的开壳双金属镍-锆物种INT4,且其价态可能会瞬态互变。在催化过程中,该双金属物种作为强效且高效的单电子还原剂,能够促进糖亲电受体生成糖自由基,并进一步与二价芳基镍反应(INT5),形成高能量的三价镍中间体INT6。实验动力学分析阐明了连续还原催化机制,进一步还原消除生成的一价镍碘物种INT7与芳基碘进行氧化加成,形成了新的三价镍INT8。该物质最终被原位生成的低价态锆试剂以单电子还原形式转化为二价芳基镍,实现了催化闭环。此外,科研人员共同合作开展理论计算阐明了空间选择性的来源(见图三,B)。在(R,R)-biOx手性配体的影响下,计算显示过渡态TS-a的空间结构相斥力更小、能垒更低,因此通过还原消除反应的催化基元步骤主导生成α-碳糖异构体。采用相同原理,(S,S)-biOx配体的引入则促进了β-碳糖异构体的形成。
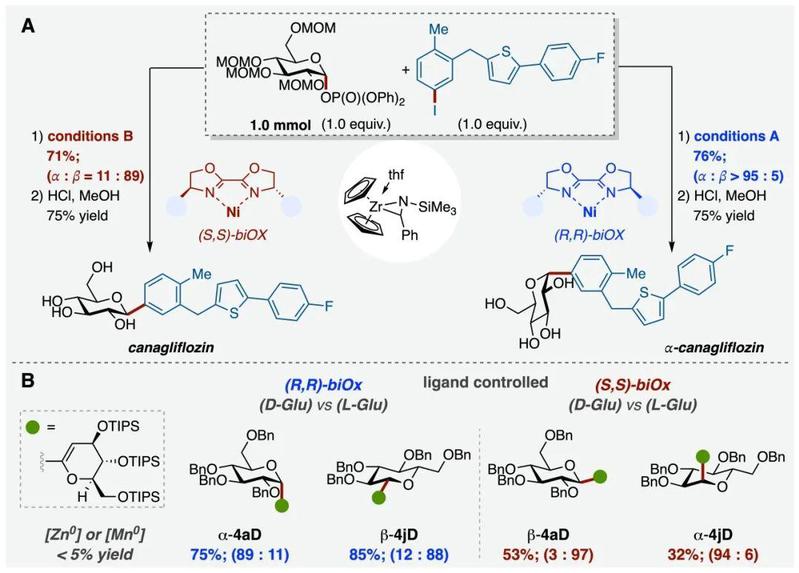
图三:锆介导手性镍催化C-糖苷化机理探索
综上,叶柏华课题组成功开发了一种在温和条件下通过手性镍催化实现的立体选择性构建C(sp2)-糖苷化方法,易合成的手性biOx配体诱导的高立体化学控制,以及对多种官能团的极好兼容性,突显了该催化体系的应用潜力。这项工作推进了不对称镍催化方法学在糖化学领域的应用,再一次证明了锆氮杂环丙烷与过渡金属催化结合策略的应用潜力。


