近日,上海科技大学物质科学与技术学院季泉江课题组报道了来自棕榈酸互营单胞菌Syntrophomonas palmitatica Cas12f1(SpaCas12f1)的生化特征及其DNA切割机制,证明CRISPR-SpaCas12f1系统能在细菌中实现多种编辑目的,且能进一步转化为哺乳动物细胞中高效的基因组编辑器,该研究成果发表于Cell Reports。

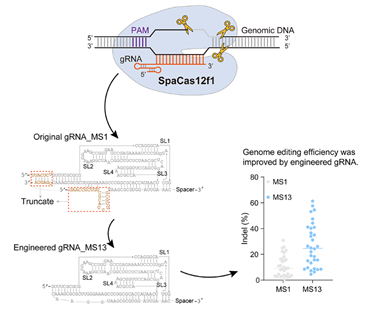
图1. CRISPR-SpaCas12f1的生化表征与改造策略CRISPR-Cas系统是目前最常用的基因编辑工具,但是传统的Cas核酸酶分子量普遍太大使其在体基因治疗的应用受限。为解决这一难题,科学家们近年来发展了小型Cas核酸酶、。其中,Cas12f核酸酶是目前最紧凑的一种,其分子量比传统Cas9和Cas12a核酸酶小一半以上,在临床治疗应用中潜力巨大,然而相应的高效Cas12f基因编辑系统却较少。
研究人员发现,来自Syntrophomonas palmitatica的紧凑型SpaCas12f1只有497个氨基酸,证明了它是一种镁离子依赖的嗜热核酸酶,可在tracrRNA和crRNA的帮助下有效切割含有5' -NTTY (Y代表C或T)PAM的双链DNA。此外,SpaCas12f1拥有与AsCas12f1相似的切割模式,即在靶向链上引入一个切口,非靶向链上引入两个切口(图1)。
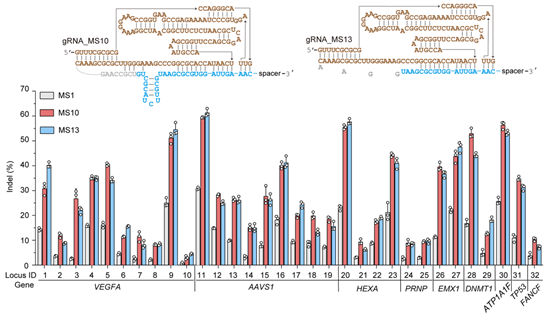
图2. 改造版CRISPR-SpaCas12f1的哺乳动物细胞编辑活性
为探究SpaCas12f1能否成为一个细菌中的高效的基因组编辑工具,研究人员引入SpaCas12f1和Lambda Red重组酶系统及单链修复模板,成功实现了CRISPR-SpaCas12f1在大肠杆菌(Escherichia coli)和肺炎克雷伯氏菌(Klebsiella pneumoniae)中多种精准的基因组编辑。同时,研究发现SpaCas12f1的tracrRNA中独特的head-to-toe的发夹结构限制了其在哺乳动物细胞的有效编辑,为此,团队设计了五种策略,系统地工程化向导RNA,成功地获得了高效的引导RNA,gRNA_MS13,从而实现CRISPR-SpaCas12f1高效哺乳动物细胞编辑(图2)。
这项研究扩展了微型CRISPR核酸酶工具库,为基因治疗和工程化微型CRISPR系统提供了新的思路。上海科技大学物质科学与技术学院季泉江组博士生王玉珏为第一作者,季泉江教授与助理研究员吴兆韡为共同通讯作者。该研究得到了临港实验室求索杰出青年基金、基金委优秀青年基金、面上项目、上海市科委原创探索项目等基金的支持。
论文标题:Guide RNA engineering enables efficient CRISPR editing with a miniature Syntrophomonas palmitatica Cas12f1 nuclease
论文链接:https://www.sciencedirect.com/science/article/pii/S2211124722012591?via%3Dihub






