生物区室化是自然长期进化的结果。数十亿年前,地球上的磷脂分子在特定的物理、化学条件下形成区室化的空间,构成了“原始细胞”。这些“原始细胞”经过长期进化,形成现在高度复杂、以细胞为基本单元的生命体系。较于开放的生化反应环境,区室化的细胞具有更低的熵、更高的效率和更稳定的机械结构。但细胞并不是完全与外界隔绝,它们通过主动/被动的跨膜运输与外界环境进行物质交换,与周围细胞进行信号传递。研究人员一直致力于人工构建类细胞的区室化系统,用来研究自然进化(如 “原始细胞”的形成)、进行高通量独立的生化反应(如单细胞测序)等。目前被广泛运用的油包水微液滴系统的一个主要问题是近乎完全隔离(溶液和生物分子无法交换),无法用于构建依赖物质交换的体外系统,这严重限制了系统在构建复杂体外合成生物学系统和高通量反应中的应用潜力。
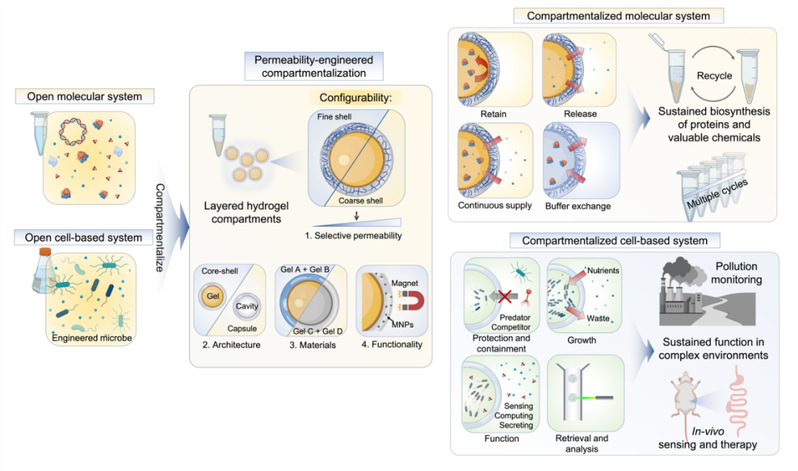
图1 渗透性可调微区室化策略示意图
刘一凡课题组开发出一种渗透性可调微区室化策略(Permeability-engineered Compartmentalization Strategy,简称PeCS),验证了该系统在构建可持续的合成生物学系统中的巨大优势(图1)。研究团队利用高通量微流控技术生成了微米级多层水凝胶微区室,区室的外层凝胶结构不仅可用作简单的物理屏障,还可以实现类似分子筛的功能:通过调节外层凝胶的孔径,整个微区室的选择透过性得以按需调控,从而实现微区室内的生物大分子甚至微生物的选择性保留与释放。除渗透性可调之外,PeCS在区室结构、水凝胶材料构成和功能化方面也具有一定的灵活性。例如:包裹磁性纳米颗粒的微区室具有磁性,可通过生物实验室通用的磁性纯化的方式来便捷地对微区室进行处理。
由PeCS构建而成的体外合成生物学系统具有显著提高的持续性与稳定性。基于PeCS的区室化无细胞蛋白质表达系统(图2)通过渗透性调节,将参与转录活动的基因和酶限制在区室内,生成的转录本RNA分子可自由扩散出区室,到外界环境中进行翻译。该系统实现了空间上的转录-翻译分隔,具有与真核生物细胞类似的特征。团队还基于PeCS构建了区室化活体细菌生物传感器,并以此为模型探究了PeCS在对基因工程化微生物(genetically modified microorganism, GMM)的生物防护及适应性提升中的作用(图3)。经验证,渗透性调控后的PeCS区室可以隔绝竞争性微生物甚至噬菌体,极大地提升了GMM在复杂真实环境中的适应性。
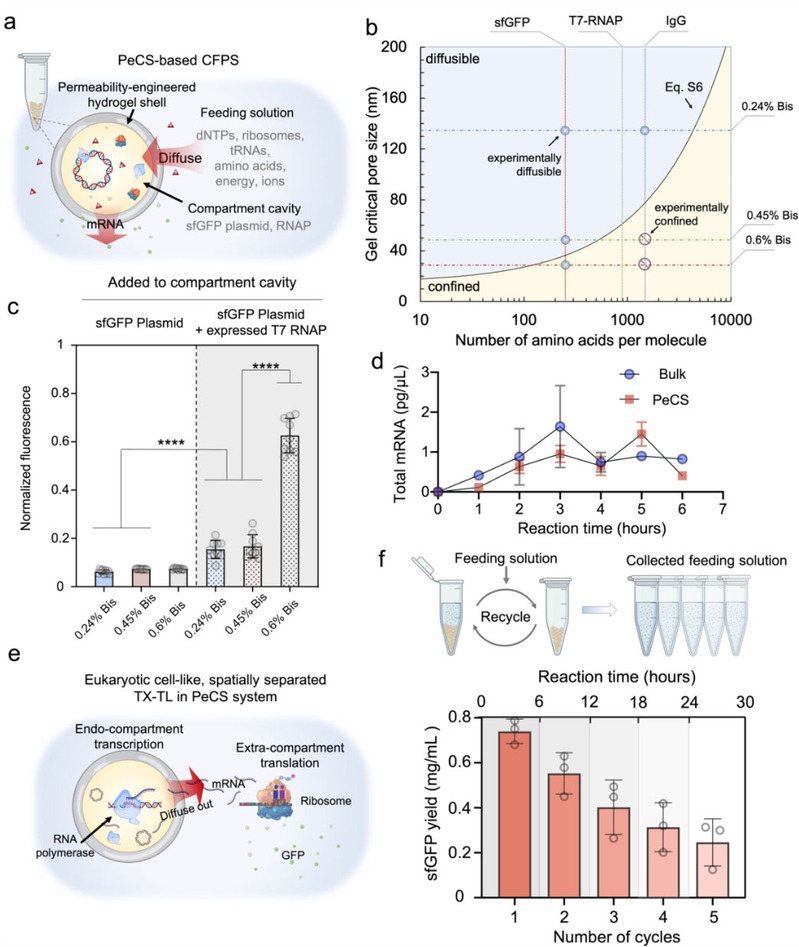
图2 基于PeCS的区室化体外蛋白质表达系统
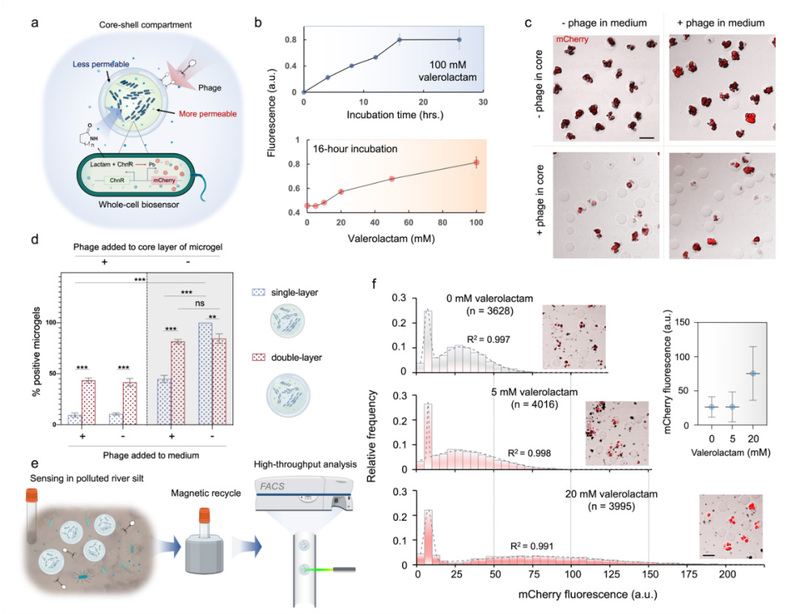
图3 基于PeCS的区室化活体细菌生物传感器


