上海科技大学物质学院杨晓瑜课题组在α,α-二取代氢化喹啉动力学拆分领域取得进展。近期,该研究成果以“Asymmetric Synthesis of Hydroquinolines with α,α-Disubstitution via Organocatalyzed Kinetic Resolution”为题,在国际知名期刊《德国应用化学》(Angewandte Chemie International Edition)上在线发表。
含氮杂环是药物化学和农药化学中最重要的结构骨架,其中四氢喹啉及其衍生物广泛存在于一系列具有生理活性的天然产物和药物分子之中,它们中的很多具有抗肿瘤、抗HIV病毒以及抗菌等活性。因此对于手性四氢喹啉结构的催化不对称合成吸引了合成化学家广泛的研究兴趣。近年来多种有效的构建手性四氢喹啉的催化不对称方法被陆续开发出来,包括不对称氢化反应、不对称加成反应以及不对称Povarov反应等。然而,这些方法大多都只适用于构建α-单取代的手性四氢喹啉产物,目前对于α,α-二取代氢化喹啉的不对称合成并没有通用的解决方案,这对进一步拓展具有手性四氢喹啉骨架的化合物在药物发现中的应用带来了很大的障碍。此外,含氮杂环的动力学拆分反应也是获得手性含氮杂环的一个有效方法,目前已有两种策略被开发用于含氮杂环的动力学拆分反应,一种是基于不对称N-酰化反应策略,一种是基于含氮杂环的不对称脱氢策略,然而目前该两种方法也都局限于α-单取代含氮杂环底物。因此开发一种有效的合成手性α,α-二取代含氮杂环的不对称催化方法成为了当务之急。
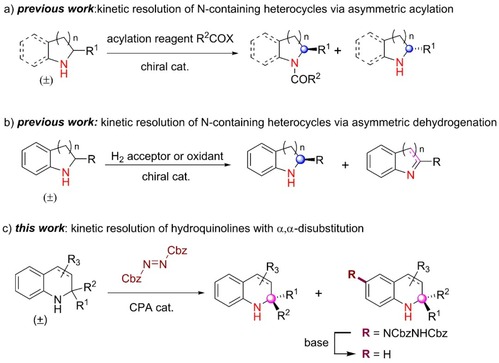
图 | 含氮杂环动力学拆分反应研究进展
杨晓瑜课题组近期致力于研究手性Brønsted酸催化苯胺类底物与偶氮二甲酸酯的新型不对称催化反应。在前期研究的基础上,团队发展了一种通过手性磷酸催化氢化喹啉与偶氮二甲酸酯的不对称远程胺化反应,实现α,α-二取代氢化喹啉的高效动力学拆分方法,为该类杂环底物的不对称合成提供了一种新的解决方案。值得一提的是,胺化产物C6-位引入的肼基可以在碱性条件下发生脱除,方便回到手性氢化喹啉原料。在最优条件下,对α,α-二取代四氢化喹啉的底物适用性的研究发现,该反应可以兼容各种芳基和烷基取代,值得一提的是α-单取代四氢化喹啉在该条件下也可以实现高效的动力学拆分。研究人员进一步将该方法拓展到更易于官能团化的α,α-二取代二氢化喹啉的动力学拆分中,证明该方法同样适用于6,6-二取代5,6-二氢菲啶的动力学拆分,构建一系列具有手性季碳中心的含氮杂环化合物,相关技术也已申请国家发明专利。
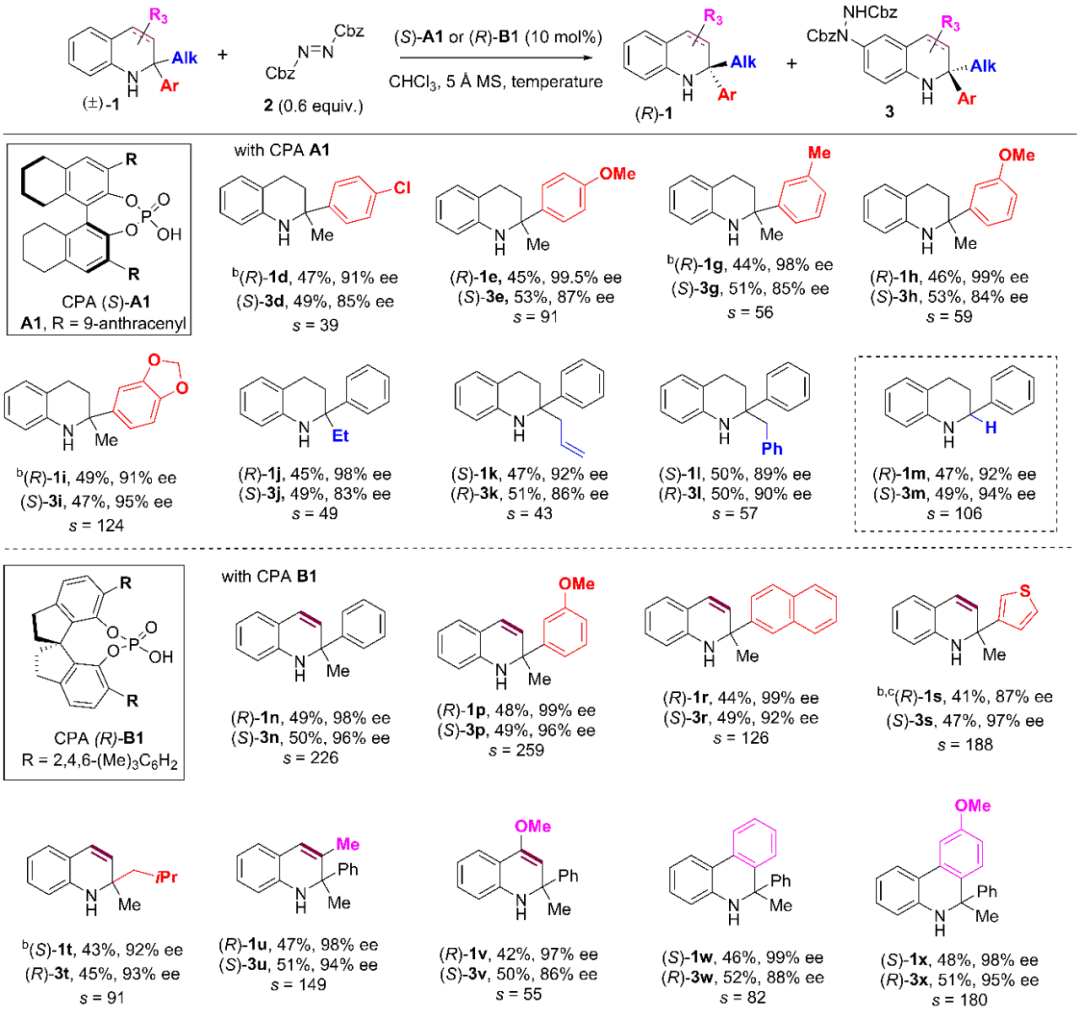
图 | 手性磷酸催化不对称胺化反应实现α,α-二取代氢化喹啉的动力学拆分
该研究还对反应的机理以及立体选择性起源进行了探索,通过底物控制实验、催化剂控制实验、Eyring分析实验、非线性效应实验、反应动力学分析和动力学同位素效应(KIE)等实验,进一步阐明了反应的机理,即手性磷酸催化剂通过双氢键活化以及非共价吸引作用(例如π-π、CH-π作用等)活化(S)-构型底物和偶氮二甲酸酯实现对位-选择性加成反应;该反应步骤是整个反应的决速步以及对映选择性决定步骤,得到的加成产物快速发生芳构化反应即得到最终胺化产物。
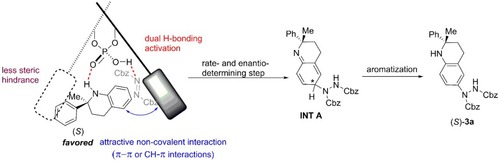
图 | 提出的反应机理和底物-催化剂作用
物质学院杨晓瑜课题组助理研究员陈运荣博士为本文第一作者,杨晓瑜教授为通讯作者,研究生朱超凡、郭政、刘炜也参与相关工作,上海科技大学为唯一完成单位。该工作得到国家自然科学基金委和上海科技大学的资助。
论文链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202015008


