
CRISPR-Cas基因编辑技术由于其简便性和高效性,已被广泛应用在生物医药、农业育种、合成生物学等领域。当下较为常用的Cas9与Cas12a核酸酶通常具有较大分子尺寸(大于1,000个氨基酸),而用于递送基因编辑器的病毒载体往往承载容量十分有限,在容纳CRISPR核酸酶与引导RNA编码序列之余已难以承载其他功能元件,因此严重限制了这类大尺寸基因编辑器的应用。近年来,发掘和鉴定小尺寸Cas核酸酶已成为基因编辑领域的研究热点。我校物质学院季泉江教授团队于2021年首次证明了一种微型基因编辑器AsCas12f1(仅包含422个氨基酸,仅有Cas9分子尺寸的三分之一)的编辑活性(Nat. Chem. Bio.,2021)。该发现在拓宽基因编辑器领域边界的同时,也引出许多科学问题,例如:如此小尺寸的核酸酶如何行使基因编辑这般复杂的生物功能?它与大尺寸核酸酶之间在演化上有什么样的联系?
为探索上述问题,我校物质学院季泉江教授团队与西湖大学申怀宗教授团队合作,通过冷冻电镜技术解析了AsCas12f1核酸酶、引导RNA和靶DNA的三元复合体的结构(分辨率为2.7 Å)。结果表明,小尺寸核酸酶AsCas12f1可以形成不对称同源二聚体结构,从而结合一分子的引导RNA,并靶向结合于靶DNA序列上,这样独特的分子结构使核酸酶AsCas12f1能够通过更小的分子尺寸来行使和大型核酸酶相似的基因编辑功能。AsCas12f1核酸酶的引导RNA亦十分独特,它包含一个多茎环组成的同轴RNA螺旋结构,对引导RNA的整体稳定性以及核酸酶活性至关重要。相较其它Cas核酸酶的同源复合体结构,研究发现该同轴RNA螺旋结构可被蛋白中额外增加的锌指结构域所替代。因此,最初的核酸酶可能仅由RNA组成,随着演化,蛋白结构元件逐渐增多,并逐步替代了RNA结构元件。这一发现为进一步理解Cas核酸酶的演化过程提供了新的证据,亦支持了RNA世界假说。研究还揭示了AsCas12f1自发形成同源二聚体的具体分子机制、识别原始间隔邻近基序(Protospacer-adjacentmotif, PAM)的关键氨基酸残基位点、以及同源二聚体中各个单体核酸酶分子对引导RNA结合、底物识别与切割的具体分工。这些发现为进一步工程改造该系统、提升其在哺乳动物细胞的基因编辑活性提供了理论基础。
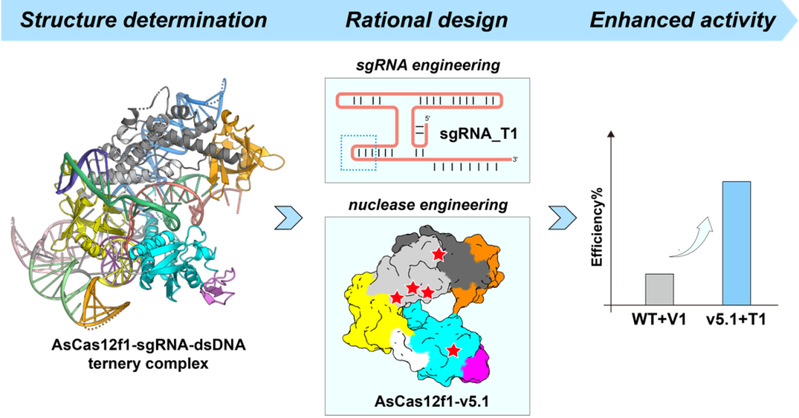
本研究还对微型基因编辑器AsCas12f1进行了工程改造,改造后的AsCas12f1-v5.1在哺乳动物细胞中的基因编辑活性较原始的野生型AsCas12f1提升了1.5~13.5倍。新的CRISPR-AsCas12f1系统具有超迷你的分子尺寸(422个氨基酸),可满足AAV等病毒递送系统对分子尺寸的严苛要求。经无偏倚、无富集的平行比较,AsCas12f1-v5.1基因编辑性能可媲美常用的大型核酸酶Cas9和Cas12a。全基因组范围内的脱靶评估表明,AsCas12f1-v5.1的基因编辑安全性显著优于常用的大型核酸酶。本研究为工程化改造CRISPR基因编辑器提供了新的参考,为基因治疗的临床应用提供了新利器。


