我校物质学院材料和物理生物学研究部钟超课题组利用基因模块方法理性设计并开发出基于哺乳动物低复杂序列蛋白的超强水下粘合涂层材料。该成果于 2019 年 8 月 23 日在Science 子刊 《Science Advances》上以“Exploiting mammalian low-complexity domains for liquid-liquid phase separation–driven underwater adhesive coatings”为题在线发表。该成果为如何在生物工程和生物材料领域开发和利用基于哺乳动物低复杂序列蛋白的液液相分离行为提供了重要启示(图1)。
近年来,哺乳动物细胞内广泛存在的液液相分离(LLPS)现象备受生物学家关注,细胞内的蛋白分子可以通过液液相分离形成液态凝结物(liquid condensates),即无膜细胞器,调节细胞内的生理活动,在突变或恶劣条件下,液态凝结物会进一步形成与神经退行性疾病相关的病理性淀粉样蛋白纤维。细胞内蛋白的这种顺序自组装(sequential assemblies)在生物学领域的重要性逐渐被发现并认可,但是很少被探索或应用到分子材料设计中。
受生物学家的研究启发,研究人员从细胞内液液相分离和固液相转变的顺序自组装过程得到灵感,开发了一种新型的基于蛋白的仿生超强水下粘合材料,首次将哺乳动物细胞中的低复杂序列蛋白应用于可控的功能生物材料领域。作者筛选并选取了哺乳动物细胞中 TDP-43 的低复杂结构域(TLC),为了获得强大的水下粘性,研究团队进一步融合了来源于海洋生物贻贝的超强足丝粘合蛋白 Mfp5 (含有大量多巴残基的 Mfp5 是使贻贝牢固结合在海底岩石上的主要界面粘合蛋白之一),构建成融合蛋白 TLC-M。实验结果表明, TLC-M 在低温下会形成高蛋白浓度的液态凝结体,这种液态凝结体具有很低的界面能,有利于蛋白吸附在水下的基底表面而不被外力冲散或溶解。随后,TLC-M 可以自发地经过液固相转变组装形成淀粉样蛋白纤维,最终形成牢固的水下粘合涂层(图2)。
研究人员利用原子力显微镜球形探针技术表征了这种粘合涂层材料的水下粘性,在酪氨酸酶催化作用下 TLC-M 分子中一部分酪氨酸残基转化成多巴残基,最终形成的粘性涂层材料的粘合能达到 48.1 mJ/m2,是目前粘性最强的水下粘合蛋白材料。由于TLC-M蛋白分子的顺序自组装驱动力来源于自身蛋白的核心α-helix 结构及其周围的疏水残基相互作用,因而该粘合材料可以在高盐浓度(≤ 1M)和较宽pH范围(3-11)的湿润或者液体环境中制备和应用。
此外,由于TLC-M 液液相分离形成的液态凝结体的流体特征,这种蛋白可以在粗糙的表面形成平整的涂层,此外也可以被注射到微管或者微流控管道等三维非规则表面形成均匀的粘性涂层,因此这种蛋白材料可广泛地应用于各种基底表面。作为水下粘合剂的一个重要展示,作者还利用 TLC-M 蛋白与和聚苯乙烯小球混合后用于特氟龙材料裂缝的填补,初步证明了该粘性材料的应用潜力(图3)。
这项研究不仅构建了类似海洋生物水下粘合剂的蛋白分子,还模拟了自然粘合剂的液液相分离和液固相转变等动态顺序自组装过程,极大程度上推动了科学家对海洋生物粘合剂分泌和粘合过程的理解,并提出了发展蛋白质材料和其他生物灵感系统工程的新策略。该研究同时还表明,低复杂结构域的液液相分离和固液相转变可以作为一种新的工程原理来指导基于蛋白质材料和其他生物启发系统的设计,为生物工程和材料工程的创造性思维打开了大门,给大家展示了如何将这些低复杂结构域的液液相分离和固液相转变应用于解决材料科学中的基本问题。该研究也是钟超课题组自2014年7月成立以来,在利用合成生物学构建基于淀粉样蛋白生物材料研究方面的又一原创性成果。
本文第一作者为上科大物质学院2016 级博士生崔孟奎,通讯作者为上科大物质学院材料和物理生物学研究部钟超研究员,上科大为第一完成单位。课题在开展过程中,得到了中科院上海有机所生物化学交叉中心刘聪教授、吉林大学张俊虎教授及其课题组成员的帮助。论文宣传图由上科大创艺学院的Julie Liu 设计并绘制。上科大物质学院分析测试平台、电镜中心、中科院上海有机化学研究所生物交叉中心为材料表征给予了大力支持。与本论文相关的工作已申请国际专利(PCT/CN2018/101219)。该研究还得到了国家自然科学基金面上项目(项目编号:31570972)、青岛海洋科学与技术国家实验室 2016 年度开放基金(项目编号:QNLM2016ORP0403),以及上科大科研启动基金的支持。
文章链接:https://advances.sciencemag.org/content/5/8/eaax3155

图1.论文概览

图2.基因模块方法理性构建水下粘合剂TLC-M,该蛋白能够通过液液相分离吸附在表面并随后在界面自组装形成纳米纤维。
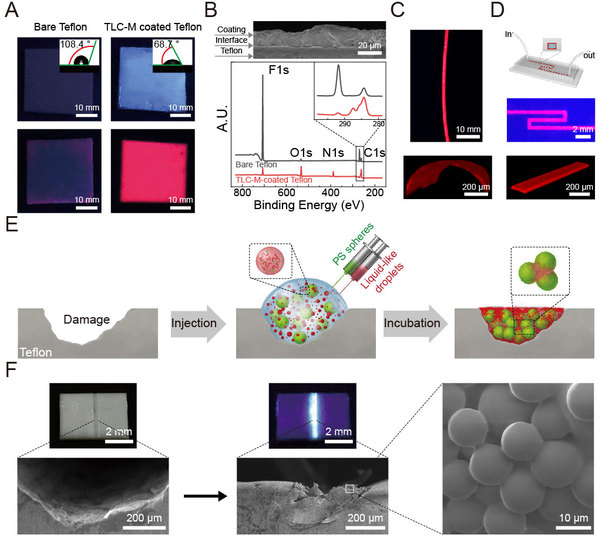
图3.液液相分离驱动的水下粘合剂TLC-M 的应用


